Contenuto
- Dosaggio
- Raccomandazioni per la prescrizione
- Effetti collaterali comuni
- Interazioni farmacologiche
- Controindicazioni e considerazioni
Harvoni è stato approvato il 10 ottobre 2014 dalla Food and Drug Administration (FDA) statunitense per l'uso negli adulti di età pari o superiore a 18 anni con infezione da HCV genotipo 1, compresi quelli con cirrosi.
Harvoni è approvato per l'uso in pazienti non trattati in precedenza ("naïve al trattamento"), così come in quelli con risposta parziale o assente alla precedente terapia anti-HCV ("con esperienza di trattamento").
Harvoni è il primo farmaco per l'HCV approvato dalla FDA che non necessita di essere assunto né con interferone pegilato (interferone peg) né con ribavirina (due farmaci tradizionalmente utilizzati per la terapia di combinazione dell'HCV, entrambi con elevati profili di tossicità).
Si dice che Harvoni abbia tassi di guarigione compresi tra il 94% e il 99%, mentre gli studi di Fase II hanno riportato un tasso di guarigione del 100% in pazienti coinfettati con HIV e HCV.
Dosaggio
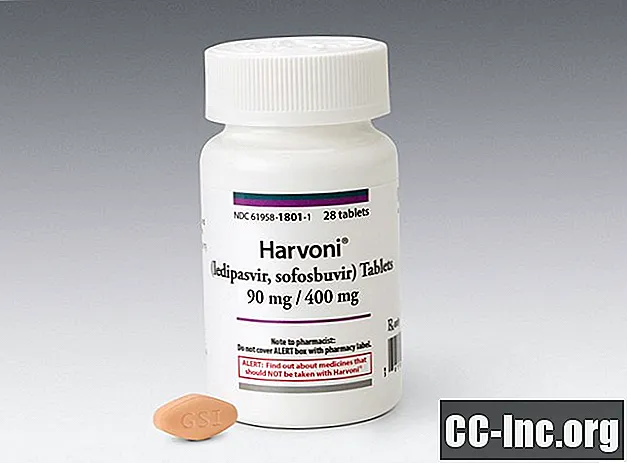
Una compressa (90 mg / 400 mg) assunta quotidianamente con o senza cibo. Le compresse di Harvoni sono a forma di diamante, color zenzero e rivestite con film, con "GSI" impresso su un lato e "7985" sull'altro.
Raccomandazioni per la prescrizione
Harvoni viene prescritto per un corso da 12 a 24 settimane, secondo le seguenti raccomandazioni:
- Naïve al trattamento con o senza cirrosi: 12 settimane
- Trattamento sperimentato senza cirrosi: 12 settimane
- Trattamento sperimentato con cirrosi: 24 settimane
Inoltre, un corso di 8 settimane può essere preso in considerazione per i pazienti naïve al trattamento senza cirrosi che hanno una carica virale HCV inferiore a 6 milioni di copie / mL.
Effetti collaterali comuni
Gli effetti indesiderati più comuni associati all'uso di Harvoni (che si verificano nel 10% o meno dei pazienti) sono:
- Fatica
- Mal di testa
Altri possibili effetti collaterali (meno del 10%) includono nausea, diarrea e insonnia.
Interazioni farmacologiche
Anche quanto segue dovrebbe essere evitato quando si usa Harvoni:
- Farmaci anti-tubercolosi a base di rifampicina: Mycobutin, Rifater, Rifamate, Rimactane, Rifadin, Priftin
- Anticonvulsivanti: Tegretol, Dilantin, Trileptal, fenobarbital
- Aptivus (tipranavir / ritonavir) utilizzato nella terapia antiretrovirale per l'HIV
- Erba di San Giovanni
Controindicazioni e considerazioni
Non ci sono controindicazioni all'uso di Harvoni in pazienti con genotipo 1 di HCV.
Tuttavia, per i pazienti con HIV che utilizzano il farmaco tenofovir (inclusi Viread, Truvada, Atripla, Complera, Stribild), deve essere prestata particolare attenzione nel monitoraggio di eventuali effetti collaterali associati a tenofovir, in particolare insufficienza renale (rene).
Gli antiacidi devono essere assunti separatamente 4 ore prima o dopo una dose di Harvoni, mentre potrebbe essere necessario ridurre i dosaggi degli inibitori della pompa protonica e dei recettori H2 (noti anche come bloccanti H2) per prevenire la diminuzione dell'assorbimento di ledipasvir.
Sebbene non vi siano controindicazioni all'uso di Harvoni in gravidanza, sono disponibili pochi dati clinici sull'uomo. Tuttavia, studi sugli animali sull'uso sia di ledipasvir che di sofosbuvir non hanno mostrato alcun effetto sullo sviluppo fetale. Si raccomanda una consulenza specialistica durante la gravidanza per valutare l'urgenza della terapia con Harvoni, in particolare se iniziare immediatamente o attendere il parto.
Si raccomanda che tutte le donne in età fertile siano monitorate mensilmente per la gravidanza durante il corso della terapia. Si raccomanda inoltre di fornire alla paziente e al suo partner maschile almeno due metodi contraccettivi non ormonali e di utilizzarli durante il corso della terapia e per i sei mesi successivi.
Guida alla discussione del medico per l'epatite C.
Ottieni la nostra guida stampabile per il tuo prossimo appuntamento dal medico per aiutarti a porre le domande giuste.

- Condividere
- Flip
- Testo