
Contenuto
- Cancro al seno ereditario
- Mutazioni geniche non BRCA
- Cancro al seno e test genetici
- Supporto per il cancro al seno ereditario
Oltre alle mutazioni del gene BRCA1 e BRCA2, alcune di queste includono mutazioni in ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2 e altro. Diamo un'occhiata a quanto siano importanti queste mutazioni non BRCA1 / BRCA2 nel carcinoma mammario familiare e ad alcune delle caratteristiche di quelle più comunemente riscontrate.
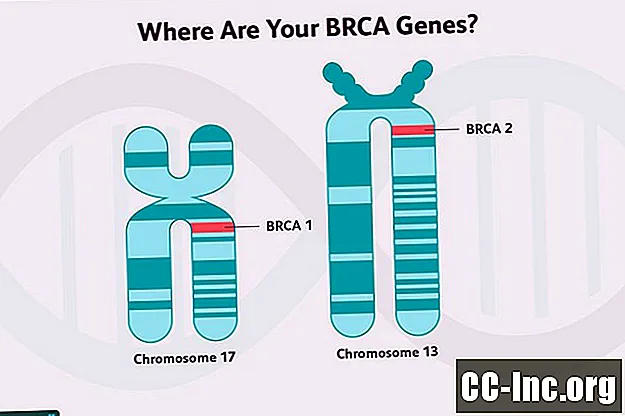
Cancro al seno ereditario
Attualmente si ritiene che dal 5 al 10% dei tumori al seno siano genetici o familiari (sebbene questo numero possa cambiare man mano che apprendiamo di più), ma non tutti questi tumori sono dovuti a mutazioni BRCA.
Al massimo, il 29% (e probabilmente molto meno) dei tumori mammari ereditari risulta positivo alle mutazioni del gene BRCA1 o BRCA2 e molte persone stanno cercando di verificare le altre modificazioni genetiche note.
Poiché la scienza alla base del cancro ereditario è molto ansiogena, per non parlare di confusione e incompleta, è utile iniziare parlando della biologia delle mutazioni geniche e di come questi cambiamenti nel DNA giocano un ruolo nello sviluppo del cancro.
Mutazioni geniche ereditate e acquisite
Quando si parla di mutazioni, è importante distinguere tra mutazioni geniche ereditate e acquisite.
Le mutazioni geniche acquisite o somatiche hanno ricevuto molta attenzione negli ultimi anni, poiché queste mutazioni causano cambiamenti che guidano la crescita del cancro. Le terapie mirate, farmaci che mirano a percorsi specifici correlati a questi cambiamenti, hanno migliorato significativamente il trattamento di alcuni tumori come il cancro ai polmoni.
Le mutazioni acquisite, tuttavia, non sono presenti dalla nascita, ma piuttosto si formano in qualsiasi momento dopo la nascita nel processo in cui una cellula diventa una cellula cancerosa. Queste mutazioni colpiscono solo alcune cellule del corpo. Non sono ereditati da un genitore, ma piuttosto "acquisiti" poiché il DNA nelle cellule è esposto ai danni dall'ambiente o come risultato dei normali processi metabolici del corpo.
Le mutazioni ereditarie o della linea germinale, al contrario, sono cambiamenti genetici con cui le persone nascono e che vengono trasmesse da uno o entrambi i genitori. Queste mutazioni colpiscono tutte le cellule del corpo. Sono queste mutazioni ereditarie (e altri cambiamenti genetici) che possono aumentare la possibilità che una persona sviluppi il cancro e spiegare ciò che è noto come cancro al seno ereditario o familiare.
Mutazioni geniche ereditarie (germinali) vs. acquisite (somatiche)In che modo le mutazioni genetiche ereditarie aumentano il rischio di cancro?
Molte persone si chiedono come esattamente un gene anormale o combinazioni di geni possano portare al cancro al seno, e una breve discussione sulla biologia è utile per comprendere molte delle domande, ad esempio perché non tutti coloro che hanno queste mutazioni sviluppano il cancro.
Il nostro DNA è un modello o un codice utilizzato per produrre proteine. Quando la mappa o il codice è sbagliato (come la "scritta" in un particolare gene), fornisce indicazioni sbagliate per sintetizzare una proteina. La proteina anormale non è quindi in grado di svolgere il suo lavoro abituale. Non tutte le mutazioni genetiche aumentano il rischio di cancro e, in effetti, la maggior parte non lo fa. Le mutazioni nei geni responsabili della crescita e della divisione delle cellule, o "mutazioni driver", sono ciò che guida la crescita dei tumori. Esistono due tipi principali di geni che, se mutati, possono portare a una crescita incontrollata nota come cancro: oncogeni e geni oncosoppressori.
Molti dei geni associati a un rischio più elevato di cancro al seno sono geni soppressori del tumore. Questi geni codificano per proteine che funzionano per riparare i danni al DNA nelle cellule (danni causati dalle tossine nell'ambiente o dai normali processi metabolici nelle cellule), servono per eliminare le cellule che non possono essere riparate o regolare la crescita in altri modi. I geni BRCA1 e BRCA2 sono geni oncosoppressori.
Molti di questi geni sono autosomici recessivi, il che significa che ogni persona eredita una copia del gene da ciascun genitore ed entrambe le copie devono essere mutate per aumentare il rischio di cancro. Semplicisticamente, ciò significa che una combinazione di fattori genetici e ambientali (una mutazione acquisita nell'altro gene) deve agire insieme per provocare lo sviluppo del cancro. In aggiunta a questo, di solito, devono verificarsi diverse mutazioni affinché una cellula diventi una cellula cancerosa.
Cosa significa avere una predisposizione genetica al cancroPenetranza genica
Non tutte le mutazioni genetiche o i cambiamenti genetici aumentano il rischio di cancro al seno nella stessa misura, e questo è un concetto importante per chiunque consideri i test genetici, soprattutto perché molte persone hanno sentito parlare dell'altissimo rischio conferito dalle mutazioni BRCA. La penetranza genica è definita come la percentuale di persone con una mutazione che sperimenteranno la condizione (in questo caso, svilupperanno il cancro al seno).
Per alcune mutazioni, il rischio di cancro al seno è molto alto. Per altri, il rischio può essere aumentato solo di un fattore 1,5. Questo è importante da capire quando si parla di possibili opzioni preventive.
Epigenetica
Un altro concetto importante che è importante per comprendere la genetica e il cancro, anche se troppo complesso per essere esplorato in dettaglio qui, è quello dell'epigenetica. Abbiamo imparato che i cambiamenti nel DNA che non comportano cambiamenti nelle coppie di basi (nucleotidi) o nelle "lettere" che codificano per una proteina, possono essere altrettanto importanti nello sviluppo del cancro. In altre parole, invece di cambiamenti strutturali nella spina dorsale del DNA, ci possono essere cambiamenti molecolari che cambiano il modo in cui il messaggio viene letto o espresso.
Mutazioni geniche non BRCA
Le mutazioni del gene BRCA sono l'anomalia genetica più nota associata al cancro al seno, ma è chiaro che ci sono donne che sono predisposte al cancro al seno in base alla loro storia familiare, che risultano negative.
Uno studio del 2017 ha rilevato che le mutazioni BRCA rappresentavano solo dal 9% al 29% dei tumori al seno ereditari. Anche quando sono stati eseguiti test per altre 20-40 mutazioni note, tuttavia, solo il 4-11% delle donne è risultato positivo. In altre parole, dal 64 all'86% delle donne sospettate di avere un carcinoma mammario ereditario è risultato negativo per entrambe le mutazioni BRCA e per altre 20-40.
Carcinoma mammario familiare non BRCA1 / BRCA2
La nostra conoscenza delle mutazioni geniche che aumentano il rischio di cancro al seno è ancora incompleta, ma ora sappiamo che ci sono almeno 72 mutazioni genetiche legate al cancro al seno ereditario. Si ritiene che queste mutazioni (e altre ancora da scoprire) siano responsabili del 70-90% dei tumori mammari ereditari che risultano negativi per le mutazioni del gene BRCA. L'acronimo BRCAX è stato coniato per descrivere queste altre mutazioni, che stanno per non- BRCA1 Carcinoma mammario familiare correlato a BRCA2.
72 Mutazioni genetiche legate al cancro al seno ereditarioLe anomalie genetiche riportate di seguito differiscono per frequenza, livello di rischio associato, tipo di cancro al seno a cui sono collegate e altri tumori associati alle mutazioni.
La maggior parte di questi tumori al seno hanno caratteristiche simili (come il tipo di cancro, lo stato dei recettori degli estrogeni e lo stato HER2) ai tumori al seno non ereditari o sporadici, ma ci sono delle eccezioni. Ad esempio, alcune mutazioni sono più fortemente associate al carcinoma mammario triplo negativo, comprese le mutazioni in BARD1, BRCA1, BRCA2, PALB2, eRAD51D.
Variabilità all'interno delle mutazioni
Non tutte le persone che hanno le seguenti mutazioni genetiche sono le stesse. In generale, ci possono essere centinaia di modi in cui questi geni vengono mutati. In alcuni casi, il gene produrrà proteine che sopprimono la crescita del tumore, ma le proteine non funzioneranno come la proteina normale. Con altre mutazioni, la proteina potrebbe non essere prodotta affatto.
BRCA (una breve revisione per il confronto)
Le mutazioni del gene BRCA 1 e le mutazioni del gene BRCA2 sono entrambe associate a un aumentato rischio di sviluppare il cancro al seno, così come alcuni altri tumori, sebbene i due differiscano in qualche modo in quel rischio.
In media, il 72% delle donne che hanno mutazioni BRCA1 e il 69% che hanno geni BRCA2 mutati svilupperanno il cancro al seno all'età di 80 anni.
Inoltre, i tumori al seno associati a queste mutazioni possono differire. I tumori al seno nelle donne che hanno mutazioni BRCA1 hanno maggiori probabilità di essere triplo negativo. Circa il 75% è negativo per i recettori degli estrogeni ed è anche meno probabile che sia HER2 positivo. Hanno anche maggiori probabilità di avere un grado di tumore più elevato. I tumori al seno nelle donne con mutazioni BRCA2, al contrario, sono simili ai tumori nelle donne che non sono portatrici della mutazione del gene BRCA.
Gene ATM (ATM serina / treonina chinasi)
Il gene ATM codifica le proteine che aiutano a controllare il tasso di crescita delle cellule. Aiutano anche nella riparazione delle cellule danneggiate (cellule che hanno subito danni al DNA dalle tossine) attivando gli enzimi che riparano questo danno.
Coloro che hanno due copie del gene mutato hanno una sindrome autosomica recessiva rara nota come atassia-teleangectasia. Con l'atassia-teleangectasia, le proteine difettose non solo aumentano il rischio di cancro, ma provocano la morte precoce di alcune cellule del cervello, provocando un disturbo neurodegenerativo progressivo.
Le persone che hanno solo una copia mutata del gene (circa l'1% della popolazione) hanno un rischio dal 20% al 60% nel corso della vita di sviluppare il cancro al seno.
Si ritiene che le persone che hanno questa mutazione siano predisposte al cancro al seno in tenera età, nonché allo sviluppo di cancro al seno bilaterale.
Lo screening del cancro al seno con risonanza magnetica al seno è raccomandato a partire dall'età di 40 anni e le donne potrebbero voler prendere in considerazione la mastectomia preventiva.Le persone con un gene ATM mutato sembrano anche essere predisposte ai tumori della tiroide e del pancreas e sono più sensibili alle radiazioni.
PALB2
Anche le mutazioni nel gene PALB2 sono un'importante causa di cancro al seno ereditario. Il gene PALB2 codifica per una proteina che funziona in combinazione con la proteina BRCA2 per riparare il DNA danneggiato nelle cellule. Nel complesso, il rischio di cancro al seno con una mutazione PALB2 nel corso della vita è pari al 58%, anche se può variare in base all'età. Il rischio è da 8 a 9 volte la media per le donne di età inferiore ai 40 anni, ma circa 5 volte la media per le donne di età superiore ai 60 anni.
Tra coloro che portano una copia del gene, il 14% svilupperà il cancro al seno entro i 50 anni e il 35% entro i 70 anni (meno che con le mutazioni BRCA).
Le persone che hanno una mutazione PALB2 e sviluppano il cancro al seno possono avere un rischio maggiore di morire a causa della malattia.
Le persone che ereditano 2 copie del gene PALB2 mutato hanno un tipo di anemia di Fanconi caratterizzata da una conta molto bassa di globuli rossi, globuli bianchi e piastrine.
CHEK2
Il gene CHEK2 codifica per una proteina che viene attivata quando si verifica un danno al DNA. Attiva anche altri geni coinvolti nella riparazione cellulare.
I rischi per tutta la vita per i portatori di mutazioni troncanti CHEK2 sono del 20% per una donna senza parenti affetti, del 28% per una donna con un parente di secondo grado affetto, del 34% per una donna con un parente di primo grado affetto e del 44% per una donna con un parente di primo e secondo grado affetto.
Sia per gli uomini che per le donne, il gene aumenta anche il rischio di cancro al colon e linfoma non Hodgkin.
CDH1
Le mutazioni in CDH1 causano una condizione nota come sindrome del cancro gastrico ereditario.
Le persone che ereditano questo gene hanno un rischio per la vita fino all'80% di sviluppare il cancro allo stomaco e fino al 52% di sviluppare il cancro al seno lobulare.
Il gene codifica per una proteina (caderina epiteliale) che aiuta le cellule ad aderire l'una all'altra (una delle differenze tra le cellule tumorali e le cellule normali è che le cellule tumorali mancano di queste sostanze chimiche di adesione che le fanno aderire). I tumori nelle persone che ereditano questa mutazione hanno maggiori probabilità di metastatizzare.
PTEN
Le mutazioni nel gene PTEN sono una delle mutazioni del gene oncosoppressore più comuni. Il gene codifica per le proteine che regolano la crescita delle cellule e aiuta anche le cellule a restare unite.
Le mutazioni nel gene sembrano aumentare il rischio che le cellule tumorali si staccino da un tumore e metastatizzino. PTEN è associata a una sindrome chiamata sindrome tumorale da amartoma PTEN e sindrome di Cowden.
Le donne portatrici di una mutazione PTEN hanno un rischio per tutta la vita di sviluppare il cancro al seno fino all'85% e hanno anche un aumentato rischio di alterazioni mammarie benigne come malattia fibrocistica, adenosi e papillomatosi intraduttale.
Le mutazioni sono anche legate a un aumentato rischio di cancro uterino (e fibromi uterini benigni), cancro della tiroide, cancro del colon, melanoma e cancro alla prostata.
I sintomi non correlati al cancro includono grandi dimensioni della testa (macrocefalia) e la tendenza a formare tumori benigni noti come amartomi.
STK11
Le mutazioni in STK11 sono associate a una condizione genetica nota come sindrome di Peutz-Jegher. STK11 è un gene soppressore del tumore coinvolto nella crescita cellulare.
Oltre a un aumento del rischio di cancro al seno (con un rischio per tutta la vita fino al 50%), la sindrome comporta un aumento del rischio di molti tumori, alcuni dei quali includono cancro al colon, cancro al pancreas, cancro allo stomaco, cancro alle ovaie, cancro ai polmoni, cancro uterino e altro ancora.
Le condizioni non correlate al cancro associate alla mutazione includono polipi non cancerosi nel tratto digerente e nel sistema urinario, lentiggini sul viso e all'interno della bocca e altro ancora. Lo screening del cancro al seno è spesso raccomandato per le donne che iniziano tra i 20 anni e spesso con risonanza magnetica con o senza mammografia.
TP53
Il gene TP53 codifica per proteine che arrestano la crescita di cellule anormali.
Queste mutazioni sono estremamente comuni nel cancro, con acquisita mutazioni nel gene p53 riscontrate in circa il 50% dei tumori.
Le mutazioni ereditarie sono meno comuni e associate a condizioni note come sindrome di Li-Fraumeni o sindrome simile a Li-Fraumeni (che ha un rischio di cancro inferiore). La maggior parte delle persone che ereditano la mutazione sviluppa il cancro all'età di 60 anni e, oltre al cancro al seno, è incline a sviluppare cancro alle ossa, cancro surrenale, cancro al pancreas, cancro al colon, cancro al fegato, tumori cerebrali, leucemia e altro. Non è raro che le persone con la mutazione sviluppino più di un cancro primario.
Si ritiene che le mutazioni ereditarie nel gene p53 rappresentino circa l'1% dei casi di cancro al seno ereditario. I tumori al seno associati alla mutazione sono spesso HER2 positivi e hanno un alto grado tumorale.
Sindrome di Lynch
La sindrome di Lynch o il cancro colorettale ereditario non poliposico è associata a mutazioni in diversi geni tra cui PMS2, MLH1, MSH2, MSH6 ed EPCAM.
La PMS2, in particolare, è stata associata a un rischio doppio di cancro al seno. Il gene funziona come un gene soppressore del tumore, codificando per una proteina che ripara il DNA danneggiato.
Oltre al cancro al seno, queste mutazioni comportano un alto rischio di tumori del colon, dell'ovaio, dell'utero, dello stomaco, del fegato, della cistifellea, dell'intestino tenue, dei reni e del cervello.
Altre mutazioni
Ci sono molte altre mutazioni geniche associate a un aumentato rischio di sviluppare il cancro al seno e si prevede che ne verranno scoperte altre nel prossimo futuro. Alcuni di questi includono:
- BRIP1
- BARD1
- MRE11A
- NBN
- RAD50
- RAD51C
- SEC23B
- BLM
- MUTYH
Cancro al seno e test genetici
Al momento, sono disponibili test per le mutazioni del gene BRCA, nonché per le mutazioni ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B e TP53, con questa area che dovrebbe espandersi drammaticamente nel prossimo futuro.
La disponibilità di questi test, tuttavia, solleva molte domande. Ad esempio, chi potrebbe avere un cancro al seno ereditario e chi dovrebbe essere sottoposto a test? Cosa dovresti fare se risulti positivo a uno di questi geni?
Idealmente, qualsiasi test dovrebbe essere eseguito solo con la guida e l'aiuto di un consulente genetico. Ci sono due ragioni per questo.
Uno è che può essere devastante apprendere di essere portatore di una mutazione che può aumentare il rischio e la guida di qualcuno che è a conoscenza della gestione e dello screening raccomandati è inestimabile.
Come notato in precedenza, alcune mutazioni conferiscono un rischio elevato e altre un rischio molto inferiore. Alcune mutazioni potrebbero essere più preoccupanti all'inizio della vita (ad esempio, nei tuoi 20 anni), mentre altre potrebbero non richiedere uno screening precoce. Un consulente genetico può aiutarti a conoscere ciò che è attualmente raccomandato per quanto riguarda lo screening per la tua particolare mutazione tenendo conto di qualsiasi altro fattore di rischio che potresti avere.
L'altro motivo per cui la consulenza genetica è così importante è che potresti avere un rischio significativo di sviluppare il cancro al seno anche se i tuoi test sono negativi. C'è ancora molto da imparare e un consulente genetico può aiutarti a esaminare la tua storia familiare per vedere se puoi comportare un rischio elevato nonostante i test negativi e pianificare lo screening di conseguenza.
Test genetici per il cancro al senoSupporto per il cancro al seno ereditario
Proprio come le persone a cui è stato diagnosticato un cancro al seno hanno bisogno di supporto, quelle che portano geni che aumentano il rischio hanno bisogno di supporto. Fortunatamente, ci sono organizzazioni che si concentrano specificamente sul supporto delle persone in questa situazione.
Un'organizzazione, FORCE, acronimo di Facing Our Risk of Cancer Empowered, offre una linea di assistenza, una bacheca e informazioni per coloro che stanno affrontando il cancro ereditario.
Altre organizzazioni e comunità di supporto sono disponibili per aiutare le persone ad affrontare le decisioni relative a una diagnosi di cancro al seno ereditario.
Il termine "previvor" è stato coniato da FORCE per descrivere le persone che stanno sopravvivendo a una predisposizione al cancro al seno. Se questa è la situazione che stai affrontando, non sei solo, e usando l'hashtag #previvor, puoi trovarne molti altri su Twitter e altri social media.
Una parola da Verywell
Può essere travolgente conoscere le molte diverse mutazioni genetiche che aumentano il rischio di cancro al seno oltre le mutazioni BRCA, ma queste "altre" mutazioni sono di importanza significativa sapendo che le mutazioni BRCA rappresentano una minoranza relativa di tumori mammari familiari. Allo stesso tempo, la scienza che esamina il cancro al seno ereditario è ancora agli inizi e c'è molto da imparare. Se sei preoccupato di avere una mutazione o di aver imparato che lo fai, è utile imparare il più possibile. Le organizzazioni di cancro ereditario come FORCE non solo possono fornirti ulteriori informazioni, ma possono aiutarti a entrare in contatto con altri che stanno affrontando un viaggio con domande e preoccupazioni simili.